INTRODUCCIÓN
En este laboratorio vamos a conocer los diferentes conceptos sobre las caracteristicas de los gases, tambien una explicacion de las diferente leyes relacionadas a ellos, por ultimo tendremos los laboratorios de boyle, charles y graham.
MARCO TEÓRICO
CONCEPTOS DE GASES:
1. ESTADOS DE AGREGACIÓN:
Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia
En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
En el estado líquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta.
el plasma es un estado de la materia en el que prácticamente todos los átomos están ionizados y con la presencia de una cierta cantidad de electrones libres, no ligados a ningún átomo o molécula. Es un fluido, formado por electrones, e iones positivos.

2. TEMPERATURA:
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
La temperatura es una magnitud referida a las nociones comunes de calor medible mediante un termómetro. En física, se define como una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como «energía cinética», que es la energía asociada a los movimientos de las partículas del sistema, sea en un sentido traslacional, rotacional, o en forma de vibraciones. A medida que sea mayor la energía cinética de un sistema, se observa que este se encuentra más «caliente»; es decir, que su temperatura es mayor.
¿Cómo se calibra un termómetro?
Mientras se está produciendo un cambio de estado la temperatura permanece constante y por ello consideramos los cambios de estado del agua (a 1 atm) como puntos de referencia.
Punto de fusión del agua:
La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
Celsius: 0
Kelvin: 273.15
Fahrenheit: 32
Punto de ebullición del agua:
La fase líquida se encuentra en equilibrio con la fase gaseosa y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
Celsius: 100
Kelvin: 373.15
Fahrenheit: 212

3. PRESIÓN:
En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:
P=FSP=FS
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
1Pa=1Nm2
Otra unidad muy utilizada para medir la presión, aunque no pertenece al Sistema Internacional, es el milímetro de mercurio (mm Hg) que representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura. Esta unidad está relacionada con la experiencia de Torricelli que encontró, utilizando un barómetro de mercurio, que al nivel del mar la presión atmosférica era equivalente a la ejercida por una columna de mercurio de 760 mm de altura.
En este caso la fuerza se correspondería con el peso (m⋅gm⋅g) de la columna de mercurio por lo que
P=m⋅gSP=m⋅gS
Como la masa puede expresarse como el producto de la densidad por el volumen (m=d⋅Vm=d⋅V), si sustituimos será:
P=d⋅V⋅gSP=d⋅V⋅gS
y dado que el volumen es el producto de la superficie de la base por la altura (V=S⋅hV=S⋅h), tenemos
P=d⋅S⋅h⋅gSP=d⋅S⋅h⋅gS
y simplificando tenemos:
P=d⋅g⋅hP=d⋅g⋅h
que nos permite calcular la presión en función de la densidad, la intensidad del campo gravitatorio y la altura de la columna. Sustituyendo los correspondientes valores en la ecuación anterior tenemos que:
Sustituyendo los correspondientes valores en la ecuación anterior tenemos que:
P=d⋅g⋅h=13600kgm3⋅9,8Nkg⋅0,76m≊101300Nm2=101300Pa
P=d⋅g⋅h=13600kgm3⋅9,8Nkg⋅0,76m≊101300Nm2=101300Pa
Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor.
La presión es la magnitud escalar que relaciona la fuerza con la superficie sobre la cual actúa, es decir, equivale a la fuerza que actúa sobre la superficie. Cuando sobre una superficie plana de área {\displaystyle A}
 se aplica una fuerza normal {\displaystyle F}
se aplica una fuerza normal {\displaystyle F} de manera uniforme, la presión {\displaystyle p}
de manera uniforme, la presión {\displaystyle p} viene dada de la siguiente forma:4
viene dada de la siguiente forma:4{\displaystyle p={\frac {F}{A}}}

En un caso general donde la fuerza puede tener cualquier dirección y no estar distribuida uniformemente en cada punto la presión se define como:
{\displaystyle p={\frac {d{\mathbf {F} }_{A}}{dA}}\cdot {\mathbf {n} }}

Donde {\displaystyle \scriptstyle {\mathbf {n} }}
 es un vector unitario y normal a la superficie en el punto donde se pretende medir la presión. La definición anterior puede escribirse también como:
es un vector unitario y normal a la superficie en el punto donde se pretende medir la presión. La definición anterior puede escribirse también como:{\displaystyle p={\frac {d}{dA}}\int _{S}\mathbf {f} \cdot \mathbf {n} \ dS}

donde:
 , es la fuerza por unidad de superficie.
, es la fuerza por unidad de superficie. , es el vector normal a la superficie.
, es el vector normal a la superficie. , es el área total de la superficie S.
, es el área total de la superficie S.4. EL VOLUMEN:
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas
En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
El volumen1 es una magnitud métrica de tipo escalar2 definida como la extensión en tres dimensiones de una región del espacio. Es una magnitud derivada de la longitud, ya que se halla multiplicando la longitud, el ancho y la altura. Matemáticamente el volumen es definible no sólo en cualquier espacio euclídeo, sino también en otro tipo de espacios métricos que incluyen por ejemplo a las variedades de Riemann
Desde un punto de vista físico, los cuerpos materiales ocupan un volumen por el hecho de ser extensos, fenómeno que se debe al principio de exclusión de Pauli. La noción de volumen es más complicada que la de superficie y en su uso formal puede dar lugar a la llamada paradoja de Banach-Tarski.
La unidad de medida de volumen en el Sistema Internacional de Unidades es el metro cúbico. Para medir la capacidad se utiliza el litro. Por razones históricas, existen unidades separadas para ambas, sin embargo están relacionadas por la equivalencia entre el litro y el decímetro cúbico
1 dm3 = 1 litro = 0,001 m3 = 1000 cm3.

5. CANTIDAD DE GAS:
La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol.
Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
¡¡¡ 602.200.000.000.000.000.000.000 !!!
La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:
masamolar=masaengramoscantidaddemoles
LEYES
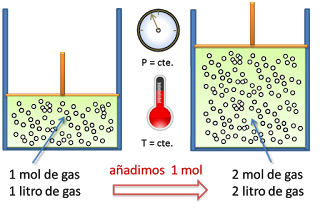
1. LEY DE AVOGRADO:
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
en 1811 afirmó que:
En iguales condiciones de presión y temperatura las densidades relativas de los cuerpos gaseosos son proporcionales a sus pesos atómicos.1
Y sugirió la hipótesis:
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas.
Por partículas se entiende aquí moléculas(O2, CO2, NH3, N2, etc.) o átomos (He, Ar, Ne, etc.).

2. LEY DE CHARLES:
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. 1Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay-Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Por otro lado, Gay-Lussac relacionó la presión y la temperatura como magnitudes directamente proporcionales en la llamada segunda ley de Gay-Lussac.
Volumen sobre temperatura: Constante (K -en referencia a sí mismo)
{\displaystyle {\frac {V}{T}}=k_{2}}

o también:
{\displaystyle V=k_{2}T\qquad }

donde:
V es el volumen.
T es la temperatura absoluta (es decir, medida en Kelvin).
k2 es la constante de proporcionalidad.
Además puede expresarse como:
{\displaystyle {\frac {V_{1}}{T_{1}}}={\frac {V_{2}}{T_{2}}}}

donde:
{\displaystyle V_{1}\,}
 = Volumen inicial
= Volumen inicial{\displaystyle T_{1}\,}
 = Temperatura inicial
= Temperatura inicial{\displaystyle V_{2}\,}
 = Volumen final
= Volumen final{\displaystyle T_{2}\,}
 = Temperatura final
= Temperatura finalDespejando T₁ se obtiene:
{\displaystyle T_{1}={\frac {V_{1}\cdot T_{2}}{V_{2}}}}

Despejando T₂ se obtiene:
{\displaystyle T_{2}={\frac {V_{2}\cdot T_{1}}{V_{1}}}}

Despejando V₁ es igual a:
{\displaystyle V_{1}={\frac {V_{2}\cdot T_{1}}{T_{2}}}}

Despejando V₂ se obtiene:
{\displaystyle V_{2}={\frac {V_{1}\cdot T_{2}}{T_{1}}}}

Un buen experimento para demostrar esta ley es el de calentar una lata con un poco de agua, al hervir el agua se sumerge en agua fría y su volumen cambia.

3. LEY DE GAY LUSSAC:
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La ley de Gay-Lussac1 establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (kelvin) permanece constante:
{\displaystyle {\frac {P}{T}}=k}

o también:
{\displaystyle P=k_{3}T\qquad }

donde:
P es la presión
T es la temperatura absoluta (es decir, medida en kelvin)
k3 una constante de proporcionalidad
4. LEY DE GASES IDEALES:
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
En 1648, el químico Jan Baptista van Helmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las génesis características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
{\displaystyle PV=k}

donde {\displaystyle k}
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante {\displaystyle k}
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:{\displaystyle P_{1}V_{1}=P_{2}V_{2}\,}

Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, aparentemente de manera independiente por August Krönig en 18561 y Rudolf Clausius en 1857.2 La constante universal de los gases se descubrió y se introdujo por primera vez en la ley de los gases ideales en lugar de un gran número de constantes de gases específicas descritas por Dmitri Mendeleev en 1874.34 5
En este siglo, los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834 como una combinación de la ley de Boyle y la ley de Charles.

5. LEY GENERALIZADA DE LOS GASES
La ley general de los gases es una ley de los gases que combina la ley de Boyle-Mariotte, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales cuando la presión es constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
{\displaystyle \qquad {\frac {PV}{T}}=K}

Donde:
P es la presión
V es el volumen
T es la temperatura absoluta (en kelvins)
K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:
{\displaystyle \qquad {\frac {P_{1}V_{1}}{T_{1}}}={\frac {P_{2}V_{2}}{T_{2}}}}

Donde presión, volumen y temperatura se han medido en dos instantes distintos 1 y 2 para un mismo sistema.
En adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.
LABORATORIO
1. SALA DE BOYLE
MATERIALES:
EL ARTEFACTO CON EL QUE SE HARA EL PROCEDIMIENTO CONSTA DE LO SIGUIENTE
-JERINGUILLA: consiste en un émbolo insertado en un tubo que tiene una pequeña apertura en uno de sus extremos por donde se expulsa el contenido de dicho tubo

- MANOMETRO ANALOGICO : El manómetro analógico de la serie tipo A le ofrece la oportunidad de registrar presiones absolutas para líquidos y para todos los gases no agresivos / no explosivos entre -1 ... +600 bar (dependiendo del modelo), en sistemas de presión

- MANOMETRO DIGITAL: El manómetro digital es un dispositivo que integra en un mismo elemento tanto el sensor de presión (eléctrico o electromecánico) y un dispositivo electrónico que dotan al instrumento de diferentes funciones interesantes para el usuario (valores mínimos y máximos, cambio de resolución, cambios de unidad,…). En función del sensor utilizado el indicador digital debe tener una tecnología de medida integrada u otra.

- EMBOLO: Pieza de una bomba o del cilindro de un motor que se mueve hacia arriba o hacia abajo impulsando un fluido o bien recibiendo el impulso de él.

PROCEDIMIENTO:
Tenemos una jeringuilla que contiene una cierta cantidad de gas que ocupa un volumen de 35ml a la presión de 1 atm y a una temperatura que se mantiene constante
cuando movemos el embolo hacemos que el gas ocupe diferentes volúmenes a la vez que se ve sometido a diferentes presiones, los valores de volumen y presión que corresponden a cada medida se van reflejando en la tabla de datos de la experimentación

2. SALA DE CHARLES:
MATERIALES:
- DEPOSITO DE VOLUMEN VARIABLE: es un instrumento volumétrico que consiste en un cilindro graduado de vidrio borosilicatado que permite contener líquidos y sirve para medir volúmenes de forma aproximada.

-TERMÓMETRO DIGITAL: son aquellos que, valiéndose de dispositivos transductores, utilizan luego circuitos electrónicos para convertir en números las pequeñas variaciones de tensión obtenidas, mostrando finalmente la temperatura en un visualizador.

PROCEDIMIENTO:
Tenemos un gas que a la temperatura de 298.15 k ocupa un volumen de 26ml. el gas esta encerrado en un deposito de volumen variable, por lo que la presión se mantiene constante.
al variar la temperatura el gas va ocupando diferentes volúmenes. los datos finales de cada proceso van quedando en la tabla de datos de la experimentación.

3. SALA DE GRAHAM:
MATERIALES:
-CONTENEDORES DE GASES: cilindros en los que se almacenan diferentes gases

-CRONOMETRO DGITAL: Es un instrumento de medida del tiempo cuya unidad es el segundo (s) SIU, este instrumento nos permite medir segundos con diferentes escalas (centésimas, milésimas) y precisiones para utilizarse en experimentos.

- SELECTOR DE VOLUMEN: para graduar que tanto volumen de gas deseas que pase

- JERINGA: consiste en un émbolo insertado en un tubo que tiene una pequeña apertura en uno de sus extremos por donde se expulsa el contenido de dicho tubo

PROCEDIMIENTO:
Podemos seleccionar varios gases para conocer la velocidad con que se escapan por el orifico es decir la velocidad de efusion.
al variar la temperatura el gas va ocupando diferentes volumenes. los datos finales de cada proceso van quedando en la tabla de datos de experimentacion

Ejercicios
Sala de Boyle
Sala de Charles
Sala Gay-Lussac
Sala de gases ideales
CONCLUSION
En este laboratorio de gases se aprecian las diferentes leyes y conceptos de los gases que debemos saber para poder experimentar con ellos con las diferentes leyes.
WEBGRAFIA
https://www.wikipedia.org/
http://www.educaplus.org/gases/lab_boyle.html























