INTRODUCCIÓN
En este blog hablaremos de la titulación de ácidos y bases. Los ejemplos tomados son de Yenka, una aplicación de laboratorios virtuales. espero que la informacion les sirva de ayuda.
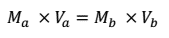
Los dos tipos principales de buretas son:
Buretas de Geissler, la llave es de vidrio esmerilado; se debe evitar que el líquido esté mucho tiempo en contacto con la bureta, pues determinados líquidos llegan a obstruir, e incluso inmovilizar, este tipo de llaves.
Bureta de Mohr, la llave ha sido sustituida por un tubo de goma con una bola de vidrio en su interior, que actúa como una válvula.

Bécquer: frasco contenedor para mezclas utilizadas en el laboratorio. n vaso de precipitado es un recipientes cilíndrico de vidrio borosilicatado fino que se utiliza muy comúnmente en el laboratorio, sobre todo, para preparar o calentar sustancias, medir o traspasar líquidos. Es cilindro con un fondo plano; se le encuentra de varias capacidades, desde 1 ml hasta de varios litros. Normalmente es de vidrio, de metal o de un plástico en especial y es aquel cuyo objetivo es contener gases o líquidos. Tiene componentes de teflon u otros materiales resistentes a la corrosión.

MARCO TEÓRICO
La titulación o valoración ácido-base es un método de análisis químico que permite determinar la concentración de una disolución ácida o básica desconocida, mediante una neutralización controlada.
Para realizar el procedimiento experimental, se debe colocar en un matraz Erlenmeyer un volumen determinado de la disolución desconocida, es decir, disolución problema. Desde una bureta se deja caer gota a gota la disolución patrón, es decir, la disolución de concentración conocida, hasta llegar al punto de equivalencia, que es el punto donde no queda ácido ni base libre en la muestra.
Para determinar en qué momento se llega al punto de equivalencia, antes de iniciar la titulación se deben agregar unas gotas de indicador, que generalmente es fenolftaleína. En el momento en que se aprecia un cambio de color del indicador, se ha llegado al punto final.
La expresión para calcular la concentración de la disolución problema es: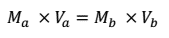
donde:
Ma = concentración molar de la disolución problema.
Va = volumen de la disolución problema.
Mb = concentración molar de la disolución patrón.
Vb = volumen de la disolución patrón
Va = volumen de la disolución problema.
Mb = concentración molar de la disolución patrón.
Vb = volumen de la disolución patrón
Este vídeo reforzara lo que aprendimos
MATERIALES
1. Bureta: son recipientes de forma alargada, graduadas, tubulares de diámetro interno uniforme, dependiendo del volumen, de litros. Su uso principal se da entre su uso volumétrico, debido a la necesidad de medir con precisión volúmenes de líquidos a una determinada temperatura.
Los dos tipos principales de buretas son:

Bécquer: frasco contenedor para mezclas utilizadas en el laboratorio. n vaso de precipitado es un recipientes cilíndrico de vidrio borosilicatado fino que se utiliza muy comúnmente en el laboratorio, sobre todo, para preparar o calentar sustancias, medir o traspasar líquidos. Es cilindro con un fondo plano; se le encuentra de varias capacidades, desde 1 ml hasta de varios litros. Normalmente es de vidrio, de metal o de un plástico en especial y es aquel cuyo objetivo es contener gases o líquidos. Tiene componentes de teflon u otros materiales resistentes a la corrosión.

Papel tornasol


PROCEDIMIENTO
Nos explican que esto nos ayudara a hallar la concentración de cualquier ácido o base





















